材料科學與工程學院胡勇團隊設計DNA微膠囊馬達益生菌遞送系統,成果發表于《自然·通訊》
4月22日,同濟大學材料科學與工程學院胡勇教授團隊在《自然·通訊》(Nature Communications)在線發表了題為“Acid-resistant chemotactic DNA micromotors for probiotic delivery in inflammatory bowel disease”的研究論文。

聚合物微球在益生菌遞送中逐漸受到關注,該微球在封裝益生菌后亦可稱為聚合物微膠囊。聚合物微膠囊為益生菌提供了類似天然細菌胞外聚合物(EPS)的環境,有助于提高益生菌的抗逆性、維持其生物活性和增殖能力。由于傳統聚合物的酸耐受性不足,現有的聚合物微膠囊對益生菌的酸保護效果仍不理想。目前,提高聚合物微膠囊對益生菌酸保護效果的策略主要集中在提高分子網絡交聯度。研究發現,較致密的分子網絡能更好地限制H+離子對封裝益生菌的侵襲。然而,靜態高交聯度不僅抑制益生菌的代謝活性,還會阻礙其在腸炎組織的有效釋放。除此之外,現有聚合物微膠囊缺乏對炎性信號的趨化能力,即不能滿足向腸炎組織主動輸運益生菌的迫切需求,面臨著益生菌在病灶部位駐留時間短、定植數量少等挑戰,極大影響益生菌療法對炎癥性腸病的治療功效。
為此,材料科學與工程學院胡勇教授課題組設計一種具有酸適應和炎癥趨化能力的DNA微膠囊馬達益生菌遞送體系。該研究團隊采用液滴微流控技術制備尺寸均一且單分散的油包水微液滴,并在該液滴水相中引發丙烯酸酯改性的寡核苷酸序列交聯形成微膠囊。經口服后,當微膠囊到達胃部和十二指腸時,寡核苷酸序列組裝成A-motif和i-motif結構,進而提高微膠囊分子網絡的交聯度,以抵御H+離子體對益生菌的侵襲。當微膠囊抵達結腸后,寡核苷酸二級結構解組裝為單鏈分子,使其交聯度降低至初始水平。
此外,在微膠囊制備過程中,將炎癥微環境響應型氣體供體分散其中,賦予其定向趨化腸炎組織的能力;將炎癥微環境敏感型分子作為交聯劑,使微膠囊在腸炎組織區域解體,以定點釋放封裝的益生菌。基于以上機制,微膠囊重塑了腸道病變組織中菌群穩態,修復了炎癥性腸病模型腸道屏障。
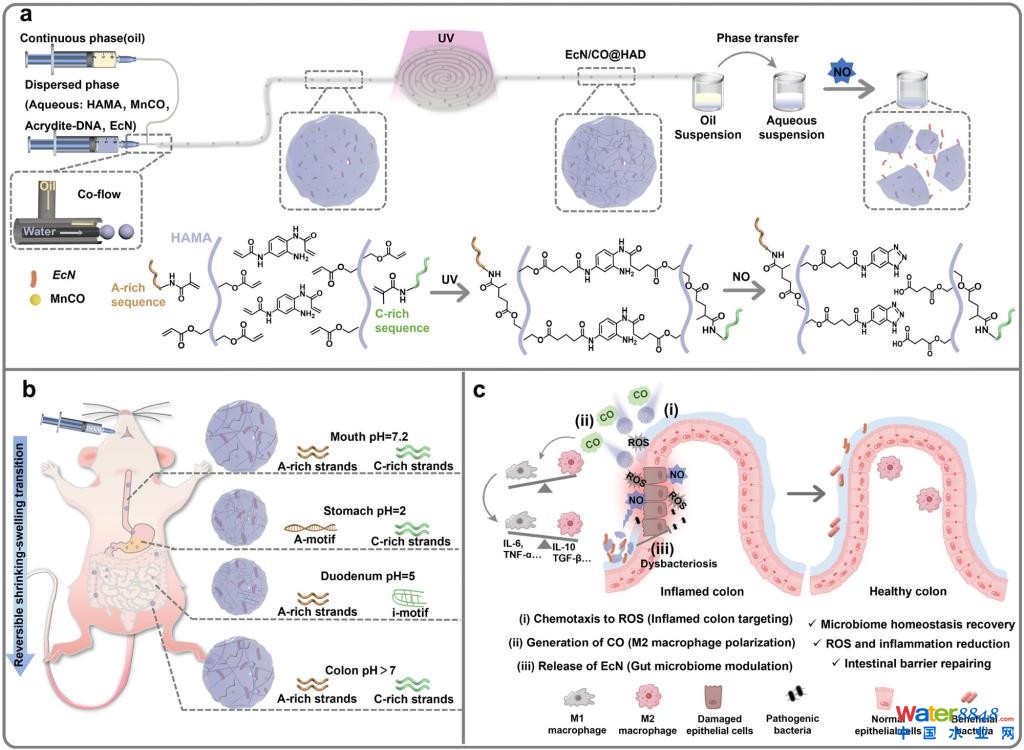
益生菌DNA微膠囊馬達的制備示意圖與炎癥性腸病治療的機理圖
同濟大學材料科學與工程學院為論文唯一完成單位,胡勇教授為論文唯一通訊作者,學院2023級材料科學與工程專業博士生趙梓楠為論文第一作者。該研究得到了國家級高層次青年人才計劃、國家自然科學基金等項目資助。
論文鏈接:https://www.nature.com/articles/s41467-025-59172-9